Влияние технологии производства на свойства фармацевтических субстанций простаты экстракта

Препараты экстракта простаты производятся из сырья животного происхождения. Отличительной особенностью этого класса препаратов является их многокомпонентный состав, который находится в прямой зависимости от вида исходного сырья, условий хранения и технологии производства активной фармацевтической субстанции (АФС). Отличия в производстве таких субстанций обусловливают и различные качественные характеристики получаемого на выходе продукта. Таким образом, препараты с одинаковым МНН, по сути, не эквивалентны друг другу, что важно, поскольку назначаются препараты, согласно установленным нормам, именно по МНН.
Немного о технологии производства АФС предстательной железы
Технология производства АФС из ПЖ крупного рогатого скота включает в себя несколько основных стадий:
- подготовка сырья;
- экстракция;
- криоструктурирование;
- выделения пептидов из экстракционной массы.
ПЖ крупного рогатого скота представляет собой железисто-мышечный орган, состоящий из пузырьковидной, содержащей основное количество регуляторных биологически активных веществ, и стволовой части. Поэтому на этапе подготовки сырья важно определить какую часть ПЖ использовать для получения экстракта. Также важно учитывать степень измельчения ПЖ, поскольку от этого будет зависеть скорость и эффективность протекания следующей стадии — экстракции.
Описанные в литературе технологии экстракции сходны, но ключевую роль играют выбор вспомогательных веществ и их концентрация. На данном этапе важно подобрать тип кислоты, а также оптимальные концентрации кислот и ионов цинка. Так, чаще всего используется уксусная кислота, поскольку она относится к типу слабодиссоциирующих кислот и не вызывает сильного набухания и дальнейшего гидролиза коллагена [1], поскольку пептидные фракции коллагена не являются целевыми для обеспечения биологической активности экстракта.
В следующем процессе — криоструктурировании — происходит образование кристаллов льда, разрывающих клеточную мембрану, в результате цитоплазматические и лизосомальные белки и биологически активные пептиды железы выходят «наружу» для последующего отделения экстракта от жмыха.
Основных способов выделения пептидов из экстракционной массы три: технология осаждения ацетоном [2, 3], направленный ферментный гидролиз [4] и ультрафильтрация на полых волокнах [5,6]. Каждый из них имеет свои особенности, влияющие на эффективность и безопасность АФС, которые детально описаны в исследовании. Например, при использовании ацетона в готовом экстракте содержится много высокомолекулярных примесей и белков, поскольку они осаждаются прежде всего. А при применение ферментативного гидролиза температуру реакционной массы увеличивают до +90 ˚С и выдерживают в течение около получаса, что может негативно сказаться на биологической активности конечного продукта, поскольку белково-пептидная фракция является термолабильной. Наиболее современным и перспективным, на взгляд авторов статьи, является метод получения экстракта с помощью ультрафильтрации, при котором продукт не подвергается дополнительной химической обработке. Основное его преимущество — максимальная безопасность и возможность обеспечить контролируемое по молекулярной массе выделение целевого пула веществ, в нашем случае — коротких регуляторных пептидов.
Совершенно очевидно, что при таком разнообразии технологий получения экстракта простаты, конечный продукт также будет отличаться. Это особенно важно понимать, поскольку ряд показателей фармацевтической субстанции может напрямую влиять на безопасность и терапевтическую эффективность готовой лекарственной формы, а нормативная документация не всегда обеспечивает достаточный уровень характеризации по этим показателям.
Дизайн и параметры исследования АФС экстракта простаты
Для иллюстрации влияния технологии на параметры фармацевтической субстанции исследователями были протестированы образцы субстанций экстракты простаты, произведенных по разным технологиям, принципиально отличающимися способом выделения пептидов: «Простатилен» субстанция-смесь, полученная по технологии тангенциальной ультрафильтрации (образец УФ), производства АО «МБНПК «Цитомед» и «Сампрост» субстанция, полученная по технологии осаждения ацетоном (образец ОА), производства ООО «Самсон-Мед». Чтобы исключить возможное влияние глицина, входящего в состав субстанции-смеси «Простатилен», для данного исследования были наработаны серии АФС без глицина. Концентрация пептидов в образцах УФ и ОА во всех исследованиях составляла около 1,33-1,34 мг/мл. Количество пептидов во всех случаях определялось методом Lowry.
Такие показатели как наличие высокомолекулярных соединений (белка) в составе фармацевтической субстанции, наличие примесей, их качественный и количественный состав, молекулярно-массовое распределение белково-пептидной фракции могут непосредственно влиять на фармакокинетические параметры лекарственного препарата, его биодоступность, безопасность, развитие побочных реакций. Также в рамках исследования оценивалась антиагрегантная, антоксидантная активность и антимикробное действие АФС.
Определение высокомолекулярных соединений (белка)
Определение белка проводят качественной реакцией с трихлоруксусной кислотой (ТХУ) с последующим сравнением с эталоном мутности. Данная реакция осаждения основана на способности этой кислоты необратимо денатурировать белок с образованием осадка. Поскольку в данной методике сравнивают мутность растворов, то в качестве эталона сравнения был выбран эталон мутности II, который даёт легкую опалесценцию. В результате проведённых опытов было определено, что эталон мутности II соответствует количеству белка (по бычьему сывороточному альбумину, БСА, с молекулярной массой 65 кДа) около 0,066 мг/мл.
На рис. 1 показаны результаты опыта, свидетельствующие о наличии высокомолекулярной фракции в образце ОА, и о низком содержании высокомолекулярной фракции в образце УФ. Так, образец УФ соответствует эталону II, тогда как образец ОА значительно превосходит его по мутности. Это означает, что субстанция, полученная осаждением ацетоном, содержит значительное количество высокомолекулярных соединений.
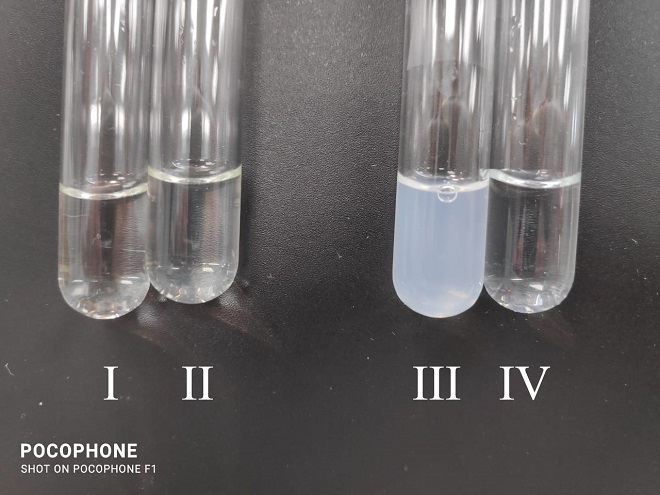
Рис.1. Сравнительная оценка высокомолекулярных примесей в качественной реакции с трихлоруксусной кислотой.
Примечание: I — образец УФ (1 мг/мл), II — образец УФ (3 мг/мл), III — образец ОА (1 мг/мл), IV — эталон мутности II.
Определение молекулярно-массового распределения
Метод гель-электрофореза основан на способности заряженных частиц, растворенных или диспергированных в электролите, перемещаться под действием внешнего электрического тока. При использовании более точного анализа высокомолекулярных примесей с помощью гель-электрофореза, который также позволяет определить молекулярно-массовое распределение белково-пептидной фракции было выявлено следующее (рис. 2):
- наличии в образце УФ пептидной фракции с молекулярной массой преимущественно в диапазоне 0-5 кДа и отсутствии фракции выше 15 кДа;
- наличии в образце ОА высокомолекулярных белков и низком содержании пептидов с массой меньше 5 кДа.
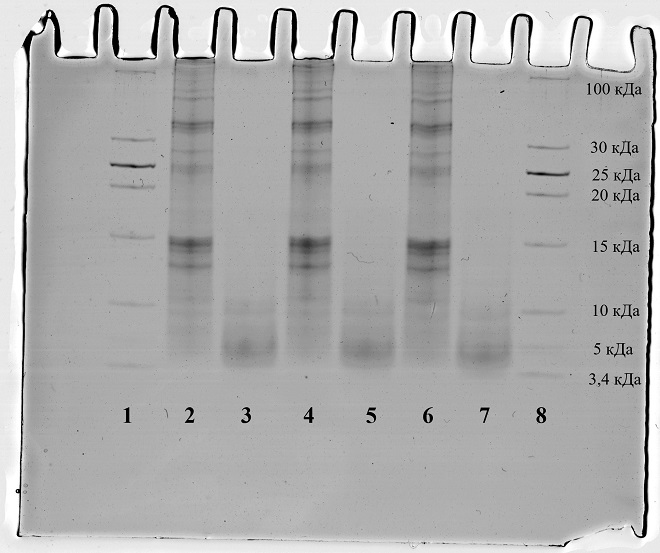
Рис.2. Гель-Электрофорез образцов субстанций в сопоставимых концентрациях (по пептидам).
Примечание: 1,8 — Контрольные маркеры, 2, 4, 6 — образец ОА, 3, 5, 7 — образец УФ.
Таким образом, по результатам гель-электрофореза видны различия в характере распределения пептидов между образцами УФ и ОА. В образце УФ основная масса вещества (пептидов) сконцентрирована в области ниже 10 кДа и преимущественно ниже 5 кДа. Напротив, в образце ОА отчетливо наблюдаются полосы выше отметки 10 кДа, что свидетельствует о наличии значительной ВМ фракции. Этот результат находится в согласии с результатами ТХУ, представленными выше.
Наличие высокомолекулярной примеси в препаратах простаты экстракта повышают риски их использования, поскольку существует опасность развития аллергических реакций, а также повышается риск прионного заражения.
Определение характерного профиля
Эксклюзионная хроматография — жидкостная хроматография, основанная на различной способности молекул разного размера проникать в поры неионогенного геля, который служит неподвижной фазой. Располагая эксклюзионной хроматограммой и калибровочной зависимостью логарифма молекулярной массы от объема (времени) удерживания можно определить молекулярно-массовое распределение исследуемого образца.
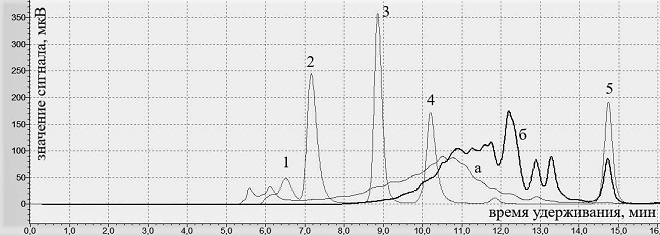
Рис.3. Хроматограммы образцов ОА, УФ и стандартов реперных соединений (детектирование при 214 нм)
Обозначения: а — образец ОА; б — образец УФ; реперные соединения: 1 — димер БСА (130 кДа), 2 — БСА (65 кДа), 3 — лактальбумин (14 кДа), 4 — апротинин (6,5 кДа), 5 — триптофан (0,2 кДа)
На рис. 3 показаны результаты опыта, свидетельствующие о наличии в водорастворимой части образца ОА пептидов и белков с молекулярной массой в диапазоне от 0,2 кДа до 130 кДа с высоким содержанием пептидов с массой 6,5-130 кДа. В то же время в образце УФ содержится низкомолекулярная фракция с молекулярной массой в диапазоне от 0,2 кДа до 14 кДа с преимущественным содержанием пептидов с молекулярной массой до 6,5 кДа и незначительного количества пептидов с молекулярной массой до 14 кДа. Таким образом, основная масса пептидов образца ОА имеют молекулярную массу > 6,5 кДа, в том числе существенное количество белков с молекулярной массой > 100 кДа. При этом содержание низкомолекулярной биодоступной пептидной фракции в образце ОА, в отличие от образца УФ, низкое.
Анализ УФ-спектров поглощения низкомолекулярной пептидной фракции образца УФ дает основание предположить наличие триптофан/триптамин-содержащих ароматических соединений. Известно, что в белках соединительной ткани КРС (коллаген, эластин) триптофан содержится либо в очень незначительных количествах, либо не содержится вовсе [7]. Факт наличия триптофан-подобных соединений в образце УФ может свидетельствовать о наличии в составе препарата пептидной фракции, полученной из регуляторных биологически активных белков, нежели из белков биологически не активной соединительной ткани.
Оценка антиоксидантной активности
Результаты проведенного исследования свидетельствуют, что 5 мг пептидов образце ОА имеет среднюю антиоксидантную активность равную 31,07%, такое же количество пептидов в образце УФ (по результатам трех серий) — 88,2% (табл.1).
Таблица 1. Экспериментальные данные, полученные в ходе определения антиоксидантной активности образцов УФ и ОА.
|
Препарат |
Серия |
Масса навески, мг |
Антиоксидантная активность, % |
|
Образец УФ |
2200920 |
47,03 |
88,03 |
|
2221020 |
48,88 |
88,20 |
|
|
2231020 |
49,54 |
88,38 |
|
|
Образец ОА |
2851119 |
27,56 |
32,60 |
|
27,10 |
30,80 |
Оценка антиагрегантной активности
Оценка степени и скорости агрегации тромбоцитов методом оптической агрегометрии выявила подавление агрегационной активности тромбоцитов образцами УФ и ОА в тесте АДФ-индуцированной агрегации (p < 0,0001). Антиагрегантный эффект образца УФ оказался выше, чем у образца ОА. Так, скорость агрегации образца УФ составила 15 % в мин, степень агрегации — 11 %, в то время как для образца ОА данные показатели составили 8 % в мин (p = 0,01) и 4 % (р = 0,003), соответственно.
Оценка антиагрегантной активности исследуемых препаратов по отношению к препарату сравнения (аспирин) показала, что у образца УФ нет достоверных различий (при пороге значимости 0,01) по влиянию на степень и скорость агрегации тромбоцитов по отношению к аспирину (рис.4 и 5), что может говорить об их схожих эффектах в подавлении агрегации тромобцитов.
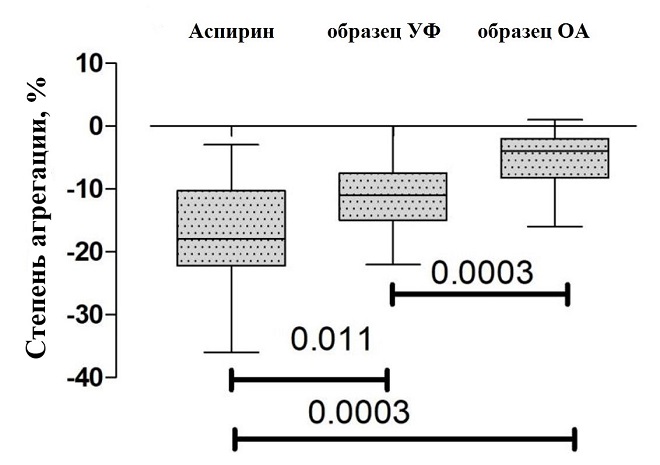
Рис.4. Значимость различий (результаты одновыборочного теста Вилкоксона) между парами препаратов для степени агрегации тромбоцитов.
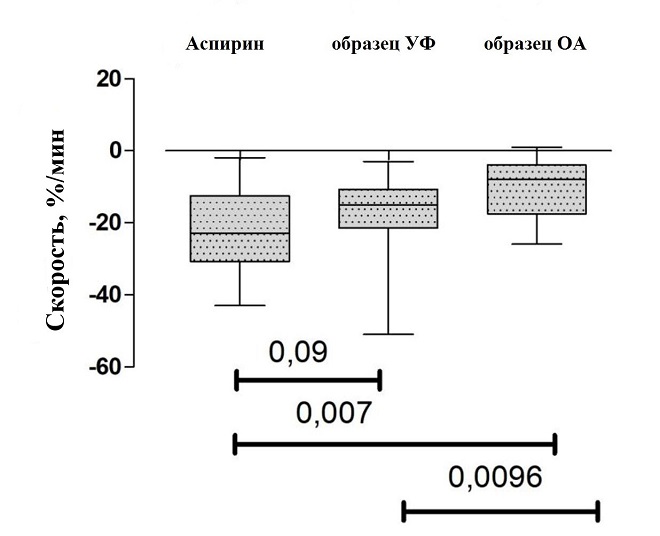
Рис.5. Значимость различий (результаты одновыборочного теста Вилкоксона) между парами препаратов для скорости агрегации тромбоцитов.
Оценка антимикробного действия
Результаты проведенного исследования свидетельствуют о наличии в условиях испытаний на микробиологическую чистоту антимикробного действия образца УФ в отношении Salmonella abony, которое устраняется при разведении образца 1:10 и об отсутствии антимикробного действия образца ОА. Глицин в данных условиях испытания антимикробным действием не обладает. Известно, что антимикробным действием могут обладать соли цинка [8], что и было подтверждено в данном исследовании. А именно, цинк хлористый в условиях испытаний на микробиологическую чистоту обладает антимикробным действием в отношении Bacillus cereus (разведение 1:50), Staphylococcus aureus (разведение 1:100), Salmonella abony (без разведения), Candida albicans (разведение 1:10) и Aspergillus brasiliensis (разведение 1:50). Однако выявленное антимикробное действие образца УФ, скорее всего, не обусловлено наличием цинка в составе субстанции, поскольку его содержание в данной субстанции составляет 0,32±0,01%, тогда как в образце ОА — 2,96±0,01%.
Выводы и результаты исследования
Проведенное сравнительное исследование физико-химических свойств двух субстанций простаты экстракта, полученных по разным технологиям, убедительно доказывают их не эквивалентность, как по параметрам безопасности, так и по параметрам эффективности. Так, АФС, полученная методом осаждения ацетоном (субстанция «Сампрост»), в том числе и ее водорастворимая фракция, в отличие от АФС «Простатилен», полученной ультрафильтрацией на полых волокнах (содержащей только водорастворимые пептиды), имеет в своем составе значительную фракцию высокомолекулярных белков, которые из готового препарата в случае повреждения целостности слизистой прямой кишки (эрозии, анальные трещины, геморрой) могут попадать в кровоток и вызывать нежелательные явления в виде аллергического или иммуногенного ответа.
С другой стороны, недостаток антиоксидантной и антиагрегантной активности субстанции «Сампрост», полученной осаждением ацетоном, снижают эффективность готового препарата в отношении лечения хронического простатита, где тромбообразование и окислительный стресс являются важными этиологическими факторами. Иными словами, различные технологии и, как следствие, состав простаты экстракта влияют на фармакологические свойства субстанции и ее активность. Таким образом, для повышения качества лекарственного препарата необходимо критически подойти к выбору оптимальных режимов технологического процесса производства входящей в препарат фармацевтической субстанции.
Авторы
С.А. Савельев1*, М.Ю. Дорош1, Т.И. Опарина2, И.А. Лагерева1, С.В. Чепанов2, О.А. Цымбалова1, С.В. Мыльников3.
1. АО «МБНПК «Цитомед», Россия, 197375, Санкт-Петербург, Орлово-Денисовский пр., д.14, стр.1
2. ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта», Россия, 199034, Санкт-Петербург, Менделеевская линия, д.3.
3. ФГБОУ ВПО «Санкт-Петербургский государственный университет», Россия, 199034, Санкт-Петербург, Университетская наб., д.7/9.
Литературные источники
1. А.Н. Михайлов, Химия и физика коллагена кожного покрова, Легкая индустрия, Москва, (1980).
2. Патент 1417244 Российская Федерация; (1994).
3. Патент 2579313 Российская Федерация; Бюл. № 10, (2016).
4. Патент 2669693 Российская Федерация; Бюл. № 29, (2018).
5. Патент 2413525 Российская Федерация; Бюл. № 28, (2005).
6. Патент 2648462 Российская Федерация; Бюл. № 9, (2018).
7. База данных UniProt Knowledgebase; https://www.uniprot.org/help/uniprotkb.
8. M. Qayyum, B. Ahmad, S. Nawazish-I-Hussain et al., Proceedings S.Z.P.G.M.I., 12(1-2), 8-12 (1998).
Полная версия статьи была опубликована в Химико-фармацевтическом журнале. Том 56, №3, 2022















